浙大医学院徐骁教授团队利用10色mIHC标记技术,挖掘肝细胞癌免疫治疗新思路
在全球范围内,肝细胞癌(HCC)以其高发病率和死亡率成为一大健康难题。中国作为HCC负担最重的国家之一,对有效治疗方法的需求尤为迫切。近年来,尽管免疫治疗为癌症治疗带来了突破性的进展,但HCC的免疫治疗响应率仍然不尽人意。在这样的背景下,一项针对HCC免疫微环境和RNA修饰作用的创新研究,为肝病治疗开辟了新的道路。
HCC的治疗面临着多方面的挑战,包括肿瘤的快速进展、治疗抵抗性以及复杂的肿瘤微环境。在众多治疗方法中,免疫治疗因其激活患者自身免疫系统攻击肿瘤的机制而非常关注。然而,HCC患者对免疫治疗的反应不一,部分患者甚至在治疗后病情加剧。因此,深入研究HCC的分子机制,探索新的治疗靶点,对于提高治疗效果、改善患者预后具备极其重大意义。
浙江大学徐骁教授、浙大一附院卫强副教授等团队在Cellular and Molecular Biology发表题为“Downregulation of N4-acetylcytidine modification in myeloid cells attenuates immunotherapy and exacerbates hepatocellular carcinoma progression”的文章。通过检验测试 HCC 免疫治疗期间各种免疫细胞亚群中 ac4C 水平的变化,验证了ac4C修饰在HCC免疫治疗中的重要作用。
然后本文研究者利用Tissue Cytometry技术,深入探究了RNA修饰ac4C在HCC免疫治疗中的作用。研究之后发现,ac4C修饰可以在一定程度上促进M1型巨噬细胞的浸润,减少骨髓源抑制细胞(MDSCs)的浸润,从而增强CTL介导的肿瘤细胞杀伤能力。更重要的是,高浸润的ac4C+CD11b+细胞与HCC患者的更好预后正相关,这为HCC治疗提供了新的生物标志物和治疗靶点。

Tissue Cytometry技术通过先进的图像分析和数据处理能力,解决了传统方法在肿瘤微环境研究中的多个难题,在本文原位数据的获取及分析方面发挥了关键作用。作者
,为研究者提供了关于肿瘤微环境中细胞分布和状态的详情信息。通过对肝细胞癌中ac4C+CD11b+细胞分布密度的定量,分析了ac4C+CD11b+细胞比例与HCC患者预后之间的关系,发现高浸润的ac4C+CD11b+细胞与更好的预后正相关。
在空间多组学数据分析方面,作者借助TSA技术标记多色标记技术,在一张样本上实现了10种蛋白标记物的免疫荧光染色:
此外,结合单细胞RNA测序(scRNA-seq)数据,作者评估了使用ac4C修饰抑制剂Remodelin hydrobromide(REM)对免疫细胞表型的影响,包括对CD8 T细胞、髓系细胞(CD11b+)、B细胞(CD20+)等的影响;分析了REM处理对髓系细胞中PDL1表达的影响,发现抑制ac4C修饰诱导了PDL1的表达;文章中对CTL(细胞毒性T淋巴细胞)的功能状态也进行了客观评估。
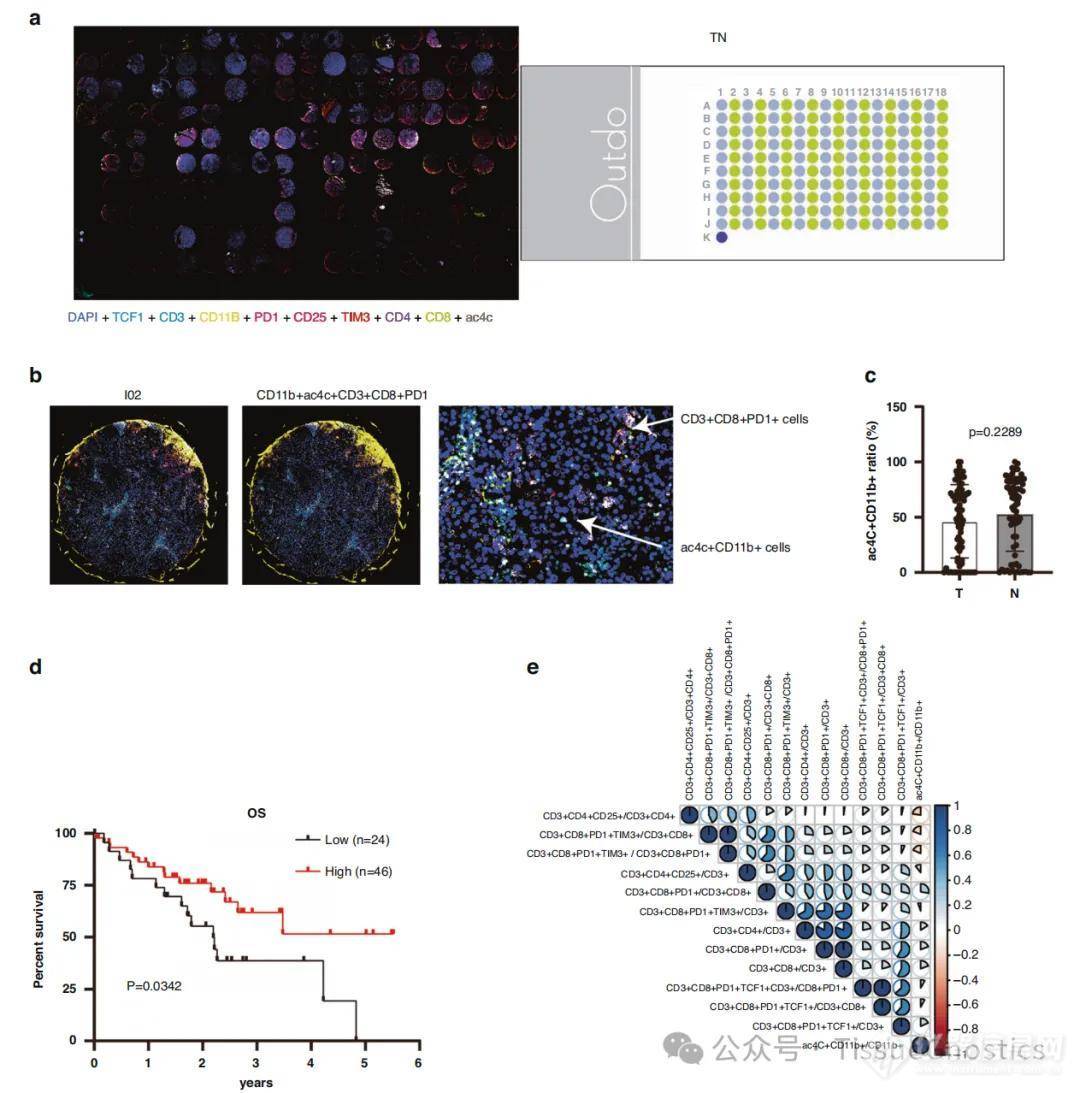
通过对肿瘤的精准分型来推动癌症精准医疗,是国家关注及重大投入的重点项目之一。对不同肿瘤的常见靶点进行IHC标记技术,已经应用于临床肿瘤的辅助诊断。通过免疫荧光IF在一张样本中进行多色标记,不仅能获得以往结合多张IHC样本才可以获得的多种标记标志物的阳性细胞含量,更能够最终靠空间距离分析其相互作用关系,这也正是肿瘤空间精准分型的意义。


国产电镜“突围战”:核心技术攻坚,中国力量如何逆袭?6月27日,见证突破!
创新破局:气体传感器和科学仪器国产替代的盈利密码——四方光电创始人熊友辉博士专访
Cancer Cell北京大学白凡教授团队利用Tissue Cytometry多组学技术解析并定义
借助Tissue Cytometry多重免疫荧光定量分析技术定义胃癌免疫治疗效果的评估模式
Tissue Cytometry结合空间多组学分析揭示前列腺癌亚型特异性治疗策略
北京大学肿瘤医院探索预后不良相关分子KIF11,有望成为食管鳞状细胞癌的新治疗靶点
Tissue Cytometry技术助力揭示CTCL病变中B细胞与恶性T细胞的相互作用
Tissue Cytometry多组学技术揭示菌群与胶质瘤的空间相互作用机制
Tissue Cytometry助力甲状腺髓样癌免疫微环境特征解析与动态调控机制
晚期胃腺癌与食管鳞癌的免疫-靶向联合治疗:OASIS II期临床试验探索
Tissue Cytometry技术辅助发现抵抗胃癌相关DNA损伤的新途径